Favorského přesmyk
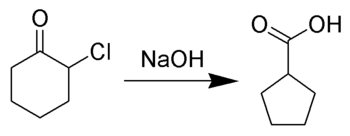
Favorského přesmyk je organická reakce, přesmyk cyklopropanonů a α-halogenketonů, kterým vznikají deriváty karboxylových kyselin nebo, u cyklických α-halogenketonů, dochází ke zmenšení kruhů. Přesmyk probíhá za přítomnosti zásady, kterou může být hydroxid (pak vzniká karboxylová kyselina) nebo alkoxid (poté vzniká ester) či amin (v takovém případě se vytvoří amid). α,α'-dihalogenované ketony při této reakci odštěpují halogenovodíky za tvorby α,β-nenasycených karbonylových sloučenin.[1][2][3][4][5]
Trihalogenmethylketony reagují odlišně a namísto přesmyku vytváří haloformovou reakcí haloformy a karboxyláty.
Mechanismus
Mechanismus reakce začíná tvorbou enolátového iontu na straně ketonu vzdálenější od atomu chloru. Enolát se následně cyklizuje na cyklopropanonový meziprodukt, který poté reaguje s hydroxidovým nukleofilem; vznik cyklopropanonu je dvouelektronovou elektrocyklizací 1,3-dipólu, jenž může vstoupit do Dielsových–Alderových reakcí. Kruh cyklopropanonu se otevírá, čímž vzniká karboanion, který je ihned protonován.[6]

Druhý krok byl také popsán jako postupný, kdy se nejprve oddělí chloridový anion za vzniku oxyallylového zwitteriontu, po němž následuje disrotační elektrocyklické uzavírání kruhu, vytvářející cyklopropanon.[7]
Při použití alkoxidu namísto hydroxidu se vytváří esterový produkt s menším kruhem.
V případech, kdy tvorba enolátu není možná, probíhá Favorského přesmyk jiným mechanismem, ve kterém se nejprve naváže hydroxid na keton, poté proběhne rozklad tetraedrického produktu a přesun sousedního uhlíku za odštěpení halogenidu; tento proces bývá označován jako pseudo-Favorského přesmyk.
 |
| Znázornění mechanismu Favorského přesmyku |
Wallachova degradace
Při Wallachově degradaci reagují s ketonem dva halogeny a po oxidaci a dekarboxylaci se utvoří keton s kratším řetězcem.[8][9]
Fotochemická Favorského reakce
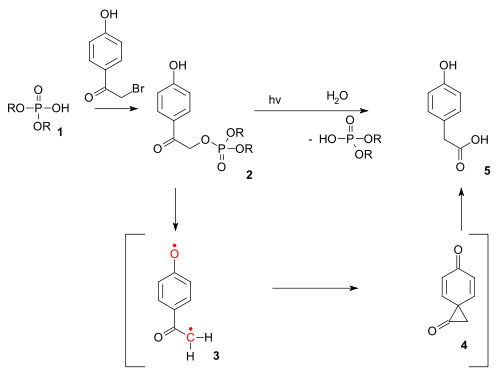
Fotochemická obdoba Favorského přesmyku může být použita na odstranění p-hydroxyfenacylových chránicích skupin z organofosfátů jako je adenosintrifosfát;[10] reakce probíhá přes tripletový diradikál (3) a diketonový spiro meziprodukt (4).[11]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Favorskii rearrangement na anglické Wikipedii.
- ↑ Arthur Cope. Organic Reaction Volume XI. New York: Wiley-Interscience, 1960. ISBN 9780471171270. DOI 10.1002/jps.2600500225.
- ↑ WOHLLEBE, J.; GARBISCH, E. W. Ring Contraction via a Favorskii-Type Rearrangement: Cycloundecanone. Org. Synth.. 1977, s. 107. Dostupné online. DOI 10.15227/orgsyn.056.0107. Je zde použita šablona
{{Citation}}označená jako k „pouze dočasnému použití“.; Coll. Vol.. S. 368. Je zde použita šablona{{Citation}}označená jako k „pouze dočasnému použití“.Je zde použita šablona{{OrgSynth}}označená jako k „pouze dočasnému použití“. - ↑ Takayuki Shioiri. New methods and reagents in organic synthesis. 2. A facile conversion of alkyl aryl ketones to α-arylalkanoic acids using diphenyl phosphorazidate. Its application to a new synthesis of ibuprofen and naproxen, nonsteroidal antiinflammatory agents. The Journal of Organic Chemistry. 1978, s. 2936–2938. DOI 10.1021/jo00408a049.
- ↑ HAMADA, Yasumasa; SHIOIRI, Takayuki. Cycloundecanecarboxylic Acid. Org. Synth.. 1982, s. 191. Dostupné online. DOI 10.15227/orgsyn.062.0191. Je zde použita šablona
{{Citation}}označená jako k „pouze dočasnému použití“.; Coll. Vol.. S. 135. Je zde použita šablona{{Citation}}označená jako k „pouze dočasnému použití“.Je zde použita šablona{{OrgSynth}}označená jako k „pouze dočasnému použití“. - ↑ GOHEEN, D. W.; VAUGHAN, W. R. Cyclopentanecarboxylic acid, methyl ester. Org. Synth.. 1963, s. 37. Dostupné online. DOI 10.15227/orgsyn.039.0037. Je zde použita šablona
{{Citation}}označená jako k „pouze dočasnému použití“.; Coll. Vol.. S. 594. Je zde použita šablona{{Citation}}označená jako k „pouze dočasnému použití“.Je zde použita šablona{{OrgSynth}}označená jako k „pouze dočasnému použití“. - ↑ Laszlo Kurti; Barbara Czako. Strategic Applications of Named Reactions in Organic Synthesis. [s.l.]: Elsevier, 2005-09-15. Dostupné online. ISBN 0-12-429785-4. S. 164–165.
- ↑ A. A. Akhrem; T. K. Ustynyuk; Yu. A. Titov. The Favorskii Rearrangement. Russian Chemical Reviews. 1970-09-30, s. 732–746. ISSN 0036-021X. DOI 10.1070/rc1970v039n09abeh002019. Bibcode 1970RuCRv..39..732A.
- ↑ O. Wallach. Zur Kenntnis der Terpene und der ätherischen Öle. Über das Verhalten zweifach gebromter hexacyclischer Ketone in Abhängigkeit von der Stellung der Bromatome. Justus Liebig's Annalen der Chemie. 1918, s. 271–296. Dostupné online. DOI 10.1002/jlac.19184140303.
- ↑ Otto Wallach. Zur Kenntnis der Terpene und der ätherischen Öle. Justus Liebig's Annalen der Chemie. 1918, s. 296–366. Dostupné online. DOI 10.1002/jlac.19184140304.
- ↑ Chan-Ho Park; Richard S. Givens. New Photoactivated Protecting Groups. 6. p-Hydroxyphenacyl: A Phototrigger for Chemical and Biochemical Probes. Journal of the American Chemical Society. 1997, s. 2453–2463. DOI 10.1021/ja9635589.
- ↑ Richard S. Givens, Dominik Heger, Bruno Hellrung, Yavor Kamdzhilov, Marek Mac, Peter G. Conrad, Elizabeth Cope, Jong I. Lee, Julio F. Mata-Segreda, Richard L. Schowen, Jakob Wirz. The Photo-Favorskii Reaction of p-Hydroxyphenacyl Compounds is Initiated by Water-Assisted, Adiabatic Extrusion of a Triplet Biradical. Journal of the American Chemical Society. 2008, s. 3307–3309. DOI 10.1021/ja7109579. PMID 18290649.
Literatura
- Příprava kubanu s využitím Favorského přesmyků.
- CHENIER, Philip J. Favorskii rearrangement in bridged polycyclic compounds. Journal of Chemical Education. 1978, s. 286. DOI 10.1021/ed055p286. Bibcode 1978JChEd..55..286C. Je zde použita šablona
{{Cite journal}}označená jako k „pouze dočasnému použití“.
Související články
- Trimethylenmethanová cykloadice; probíhající podobným mechanismem
- Homo-Favorského přesmyk, přesmyk β-halogenovaných ketonů a cyklobutanonů