Dimethylquecksilber
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
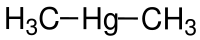 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dimethylquecksilber | |||||||||||||||
| Andere Namen | Dimethylhydrargyrum (Latein) | |||||||||||||||
| Summenformel | C2H6Hg | |||||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit mit süßlichem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 230,65 g·mol−1 | |||||||||||||||
| Aggregatzustand | flüssig | |||||||||||||||
| Dichte | 3,1 g·cm−3 [1] | |||||||||||||||
| Schmelzpunkt | −42 °C[1] | |||||||||||||||
| Siedepunkt | 92 °C[1] | |||||||||||||||
| Dampfdruck | 66 hPa (20 °C)[1] | |||||||||||||||
| Löslichkeit | praktisch unlöslich in Wasser[1] | |||||||||||||||
| Brechungsindex | 1,5452 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | nicht festgelegt[1] | |||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | 59,8 kJ/mol[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Dimethylquecksilber stellt eine Organometallverbindung des Quecksilbers und ein starkes Nervengift dar. Die Dämpfe riechen schwach süßlich.[5]
Eigenschaften
Dimethylquecksilber ist eine leicht flüchtige, farblose Flüssigkeit mit süßlichem Geruch, welche praktisch unlöslich in Wasser ist. Sie zersetzt sich beim Erhitzen, wobei Quecksilberdämpfe und leicht entzündliche Zersetzungsprodukte entstehen.[1]
Verwendung
Reines Dimethylquecksilber wurde früher als Referenz in der Kernspinresonanzspektroskopie (NMR) verwendet. Spektroskopische Untersuchungen von Quecksilberverbindungen mit der Methode basieren auf dem Isotop 199Hg, das etwa 17 % in natürlichem Quecksilber ausmacht. Reines Dimethylquecksilber eignet sich gut als Standard, da es eine stabile Flüssigkeit ist und eine hohe Konzentration an Quecksilber-Atomen enthält. Probleme durch Abhängigkeiten der spektroskopischen Eigenschaften vom Lösungsmittel, die bei 199Hg ausgeprägt ist, können so vermieden werden. Trotz der extremen Giftigkeit der Verbindung wird sie noch gelegentlich eingesetzt. Alternativ können in vielen Fällen Lösungen von Quecksilber(II)-chlorid oder Quecksilber(II)-perchlorat verwendet werden. Eine andere Möglichkeit ist die Verwendung der Unified Chemical-Shift Scale, bei der die chemische Verschiebung für beliebige Kerne auf den Standard von Tetramethylsilan in Deuterochloroform bezogen wird.[6]
Sicherheitshinweise
Dimethylquecksilber bildet giftige Dämpfe und kann beim Einatmen, aber auch bei Hautkontakt zu tödlichen Konzentrationen im Körper führen. Es kann die Blut-Hirn-Schranke (BHS) passieren und bildet vermutlich einen Komplex mit Cystein. Es wird angenommen, dass es vor dem Eindringen ins Zentrale Nervensystem zu Methylquecksilber metabolisiert wird. Neopren-, Latex- und Polyvinylchlorid-Handschuhe sind nicht geeignet zum Schutz. Diese Tatsache führte zum Tod der US-amerikanischen Chemikerin Karen Wetterhahn. Bei nicht auszuschließendem Handkontakt werden für Arbeiten bis zu 4 Stunden Nitrilkautschuk-Handschuhe über Handschuhen aus einem PE/Ethylen-Vinylalkohol-Copolymer-Laminat (EVOH)[7] empfohlen.[8]
Beim Auftreten von Vergiftungserscheinungen wie Schwindelanfällen oder Kopfschmerzen ist es häufig schon zu spät für eine effektive Therapie. Dimethylquecksilber wird im Körper nur langsam abgebaut, so dass es zu einer Akkumulation kommen kann. Der intraperitoneale LD50-Wert für Mäuse liegt bei 37,5 mg/kg Körpergewicht, jedoch kann die Exposition mit selbst kleinen Mengen (wie über die Hand verschütteter Flüssigkeit) zu starken Vergiftungen bis hin zum Tod führen. Eine effektive Behandlung der Vergiftung ist nicht bekannt.
Bekannte Todesfälle
- Karen Wetterhahn, eine US-amerikanische Chemikerin, kam 1997 als Folge eines Laborunfalls mit Dimethylquecksilber ums Leben[9]
- Christoph Bulwin, einem deutschen Informatiker, wurde 2011 bei einem Giftanschlag mit einer Spritze Dimethylquecksilber injiziert, er starb 2012 an den Folgen
Weblinks
- Berufsgenossenschaft Chemie: Unfallbericht Dimethylquecksilber-Vergiftung
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu Dimethylquecksilber in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-130.
- ↑ Eintrag zu Dimethylmercury im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- ↑ OSHA Safety Hazard Information Bulletin on Dimethylmercury. In: Safety and Health Information Bulletins (SHIBs), 1997–1998. OSHA, 15. Februar 1991; abgerufen im 1. Januar 1 (englisch).
- ↑ David Z. Zee, Christopher P. Singer, Thomas V. O’Halloran: Chemical-Shift Standards for 199 Hg NMR Spectroscopy, 25 Years Later. In: Inorganic Chemistry. Band 61, Nr. 35, 5. September 2022, S. 13657–13661, doi:10.1021/acs.inorgchem.2c02183, PMID 35994515, PMC 9452467 (freier Volltext) – (englisch).
- ↑ Produktfamilie Silvershield der Firma Honeywell International Inc.
- ↑ Gefahrstoff-Information des GisChem zu Dimethylquecksilber.
- ↑ Sam Lemonick: 25 Years After Karen Wetterhahn Died of Dimethylmercury Poisoning, Her Influence Persists: Chemist left her mark on lab safety, the scientific method, and women in science. In: ACS Chemical Health & Safety. Band 29, Nr. 4, 25. Juli 2022, S. 327–332, doi:10.1021/acs.chas.2c00043.













