SOS válasz

Az SOS válasz (magyar (is) szakirodalomban gyakran SOS repair[3]) egy DNS károsodásakor kiváltott globális reakció amelyben a sejtciklus leáll, a DNS helyreállítása és mutagenezise megkezdődik. A a reakció része a RecA fehérje (eukariótákban Rad51). Az egyszálú DNS által stimulált RecA fehérje részt vesz az SOS válaszgének represszorának (LexA) inaktiválásában, ezáltal indukálva a választ. Ez egy hiba következtében induló helyreállító rendszer, amely jelentős mértékben hozzájárul a fajok széles körében megfigyelt DNS-változásaikhoz.
Felfedezés
Az SOS-választ 1975-ben Miroslav Radman fedezte fel és nevezte is el.[4]
Mechanizmus
Normális növekedés során az SOS-géneket a LexA represszor fehérje dimerek negatívan szabályozzák. Normális körülmények között a LexA egy 20 bp hosszúságú konszenzus szekvenciához (az SOS dobozhoz, más néven SOS-régióhoz) kötődik az említett gének operátor régiójában. Ezen SOS gének némelyike még represszált állapotban is bizonyos szinten expresszálódik (kifejeződik) a LexA SOS-dobozukhoz (SOS-régiójukhoz) való affinitásának megfelelően. Az SOS-gének aktiválódása DNS-károsodás után történik a replikációs villáknál keletkező egyszálú (ssDNS) régiók felhalmozódása révén, ahol a DNS-polimeráz blokkolva van. A RecA ATP-függő módon filamentumot képez ezen ssDNS-régiók körül, és aktiválódik. A RecA aktivált formája kölcsönhatásba lép a LexA represszorral, hogy elősegítse a LexA represszor önleválasztását az operátorról.
Amint a LexA-koncentráció csökken, az SOS-gének repressziója az SOS-dobozokhoz való LexA-affinitás szintjének megfelelően csökken. A LexA-t gyengén kötő operátorok az elsők, amelyek teljes mértékben expresszálódnak. Ily módon a LexA szekvenciálisan aktiválhatja a különböző javítási mechanizmusokat. A gyenge SOS-dobozzal rendelkező gének (mint például a lexA, recA, uvrA, uvrB és uvrD) még a gyenge SOS-indukáló kezelések hatására is teljes mértékben indukálódnak. Így az első indukálandó SOS-javító mechanizmus a nukleotid-kivágási javítás (NER), amelynek célja a DNS-károsodások kijavítása anélkül, hogy teljes körű SOS-válaszra kényszerítené magát. Ha azonban a NER nem elegendő a károsodás kijavításához, a LexA-koncentráció tovább csökken, így az erősebb LexA-dobozokkal rendelkező gének (például sulA, umuD, umuC - ezek későn expresszálódnak) expressziója indukálódik. A SulA a sejtosztódást azáltal állítja le, hogy az FtsZ-hez, a folyamatot elindító fehérjéhez kötődik. Ez okozza a filamentumképződést, és az UmuDC-függő mutagén javítás indukcióját. E tulajdonságok eredményeként egyes gének részben indukálódhatnak még endogén DNS-károsodásra is, míg más gének csak akkor jelennek meg, ha a sejtben magas vagy tartós DNS-károsodás van jelen.
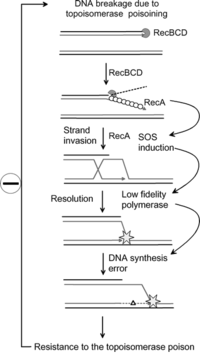
Antibiotikum-rezisztencia
A közelmúlt kutatásai kimutatták, hogy az SOS válaszreakció elengedhetetlen lehet az egyes antibiotikumokkal szembeni rezisztenciához vezető bakteriális mutációk megszerzésében.[5] Az SOS válasz során a mutációs ráta megnövekedését három DNS-polimeráz okozza: Pol II, Pol IV és Pol V. Kutatók ezeket a fehérjéket célozzák meg olyan gyógyszerek létrehozása céljából, amelyek megakadályozzák az SOS helyreállítást. Ezek segítségével meghosszabbítható a kórokozó baktériumok antibiotikum-rezisztenciájának kialakulásához szükséges idő, ezáltal javítva az antibiotikumot tartalmazó gyógyszerek hosszú távú hatóképességét.[6]
Genotoxicitás vizsgálata

Az Escherichia coli-ban a DNS-károsító ágensek különböző osztályai indíthatják el az SOS-választ a fentiekben leírtak szerint. A lac-operont (amely a béta-galaktozidáz - egy laktózt lebontó fehérje termeléséért felelős) egy SOS-hez kapcsolódó fehérje irányítása alá helyező operonfúzió előnyeit kihasználva lehetővé válik a genotoxicitás egyszerű kolorimetriás vizsgálata. A baktériumhoz laktózanalógot adunk, amelyet aztán a béta-galaktozidáz lebont, és így egy színes vegyület keletkezik, amely spektrofotometriával kvantitatív módon mérhető. A színfejlődés mértéke a termelt béta-galaktozidáz közvetett mérőszáma, amely maga közvetlenül összefügg a DNS-károsodás mértékével
Az E. coli baktériumokat tovább módosítják, hogy számos mutációval rendelkezzenek, köztük egy uvrA mutációval, amely a törzset hiányossá teszi az excíziós javításban, ami növeli a választ bizonyos DNS-károsító anyagokra, valamint egy rfa mutációval, amely a baktériumokat lipopoliszacharid-hiányossá teszi, ami lehetővé teszi bizonyos vegyi anyagok jobb diffúzióját a sejtbe az SOS-válasz kiváltása érdekében. A kereskedelemben kaphatók olyan készletek, amelyek az E. coli sejt genetikai károsodásra adott elsődleges válaszát mérik, és bizonyos anyagok esetében nagymértékben korrelálhatnak az Ames-teszttel.
Egyéb képek
-
 Az SOS-válasz gátolja a szeptumképződést, amíg a bakteriális DNS-t nem lehet javítani, és a sejtek mikroszkópos vizsgálatakor filamentáció formájában meg nem figyelhető (a kép jobb felső részén).
Az SOS-válasz gátolja a szeptumképződést, amíg a bakteriális DNS-t nem lehet javítani, és a sejtek mikroszkópos vizsgálatakor filamentáció formájában meg nem figyelhető (a kép jobb felső részén).
Jegyzetek
- ↑ (1982. május 1.) „The SOS regulatory system of Escherichia coli”. Cell 29 (1), 11–22. o. DOI:10.1016/0092-8674(82)90085-X. PMID 7049397.
- ↑ Michel B (2005. július 1.). „After 30 years of study, the bacterial SOS response still surprises us”. PLOS Biology 3 (7), e255. o. DOI:10.1371/journal.pbio.0030255. PMID 16000023.

- ↑ Repair. www.hefop.u-szeged.hu. [2021. április 27-i dátummal az eredetiből archiválva]. (Hozzáférés: 2021. április 27.)
- ↑ Radman (1975). „Phenomenology of an inducible mutagenic DNA repair pathway in Escherichia coli: SOS repair hypothesis”. Basic Life Sciences 5A, 355–367. o. DOI:10.1007/978-1-4684-2895-7_48. PMID 1103845.
- ↑ Cirz (2005. június 1.). „Inhibition of mutation and combating the evolution of antibiotic resistance”. PLOS Biology 3 (6), e176. o. DOI:10.1371/journal.pbio.0030176. PMID 15869329.

- ↑ Lee (2005. július 1.). „A molecular target for suppression of the evolution of antibiotic resistance: Inhibition of the Escherichia coli RecA Protein by N6-(1-Naphthyl)-ADP”. Journal of Medicinal Chemistry 48 (17), 5408–5411. o. DOI:10.1021/jm050113z. PMID 16107138.
Fordítás
- Ez a szócikk részben vagy egészben a SOS response című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
 Biológiaportál
Biológiaportál Orvostudományi- portál
Orvostudományi- portál












