Difenilzinco

| Difenilzinco | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Difenilzinco | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C12H10Zn |
| Massa molecolare (u) | 219.59 g/mol |
| Numero CAS | 1078-58-6 |
| Numero EINECS | 214-082-2 |
| PubChem | 517896 |
| SMILES | C1=CC=[C-]C=C1.C1=CC=[C-]C=C1.[Zn+2] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 | |
| Frasi H | 228 - 250 |
| Modifica dati su Wikidata · Manuale | |
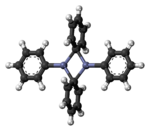
Il difenilzinco è un composto organico dello zinco ed è considerato l'equivalente sintetico di un sintone feniluro (Ph-). Il difenilzinco isolato esiste come dimero PhZn(μ-Ph)2ZnPh allo stato solido (e non solvato).[1]

Il difenilzinco è disponibile in commercio, in alternativa lo si può sintetizzare con 3 metodi differenti:
- facendo reagire il fenillitio con il bromuro di zinco:[2]
- ,
- facendo reagire il bromuro di fenilmagnesio con il cloruro di zinco;
(entrambe le reazioni summenzionate sono favorite in accordo alla teoria H.S.B.A.)
(quest'ultima invece è una RedOx favorita dalla riduzione del mercurio, che ha un potenziale di riduzione notevolmente superiore a quello dello zinco : in acqua circa +0,8 V vs –0,74 V).
La relativa stabilità del difenilzinco è dovuta all'impossibilità intrinseca di subire due reazioni di decomposizione tipiche invece degli alchili dei metalli di transizione : l'α–eliminazione di idruro metallico (a sua volta spesso instabile), poiché non ci sono idrogeni sul carbonio legato a Zn), e soprattutto la β–eliminazione, poiché produrrebbe un intermedio di natura benzinica estremamente instabile.
Il composto è infatti termicamente stabile (b.p. 280-285°/760 mm), tuttavia è sensibile all'aria ed all'umidità.
Note
- ^ Peter R. Markies, Gerrit Schat, Otto S. Akkerman, Friedrich Bickelhaupt, Wilberth J. J. Smeets e Anthony L. Spek, Coordinational behavior of solvent-free diorganylzinc compounds: the remarkable x-ray structure of dimeric diphenylzinc, in Organometallics, vol. 9, n. 8, 1990, pp. 2243, DOI:10.1021/om00158a022.
- ^ David Y. Curtin e John L. Tveten, Reaction of Diarylzinc Reagents with Aryldiazonium Salts. Direct Formation of cis-Azo Compounds, in J. Org. Chem., vol. 26, n. 6, 1961, pp. 1764, DOI:10.1021/jo01065a017.
- ^ P Markies, Gerrit Schat, Otto S. Akkerman, F. Bickelhaupt e Anthony L. Spek, Complexation of diphenylzinc with simple ethers. Crystal structures of the complexes Ph2Zn·glyme and Ph2Zn·diglyme, in J. Organomet. Chem., vol. 430, 1992, pp. 1–13, DOI:10.1016/0022-328X(92)80090-K.
- ^ (EN) Guillaume Pelletier, Diphenylzinc, in Encyclopedia of Reagents for Organic Synthesis, Chichester, UK, John Wiley & Sons, Ltd, 2013, DOI:10.1002/047084289x.rn01548, ISBN 978-0-471-93623-7.
Altri progetti
Altri progetti
- Wikimedia Commons
 Wikimedia Commons contiene immagini o altri file su Difenilzinco
Wikimedia Commons contiene immagini o altri file su Difenilzinco
V · D · M  Composti dello zinco Composti dello zinco | ||||
|---|---|---|---|---|
| Zinco(I) |
|  | ||
| Zinco(II) | ZnBr2 · Zn(CN)2 · ZnCl2 · Zn(ClO3)2 · ZnCrO4 · ZnF2 · ZnH2 · ZnI2 · ZnMoO4 · Zn(NO3)2 · Zn(NO2)2 · ZnO · ZnO2 · Zn(OH)2 · ZnS · ZnSO4 · ZnSe · ZnTe · Zn2P2O7 · Zn3Sb2 · Zn3As2 · Zn3N2 · Zn3P2 · Zn3(PO4)2
| |||
 Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia
Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia












