Osmocene
| Osmocene | |
|---|---|
 | |
| Nome IUPAC | |
| osmocene, bis(η5-ciclopentadienil)osmio(II) | |
| Nomi alternativi | |
| Os(C5H5)2, OsCp2 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C10H10Os |
| Aspetto | solido bianco |
| Numero CAS | 1273-81-0 |
| Numero EINECS | 215-055-8 |
| PubChem | 79163, 102601604 e 6432038 |
| SMILES | [CH-]1C=CC=C1.[CH-]1C=CC=C1.[Os+2] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2,64[1] |
| Temperatura di fusione | 229 °C (502 K)[2] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 | |
| attenzione | |
| Frasi H | 315 - 319 - 335 [3] |
| Consigli P | 101 - 102 - 103 - 262 - 280 - 305+351+338 - 304+340 - 403+233 - 501 [3] |
| Modifica dati su Wikidata · Manuale | |
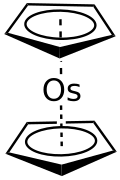
L'osmocene è il composto metallorganico con formula Os(C5H5)2, spesso abbreviata come OsCp2. Appartiene alla categoria dei composti a sandwich e più in particolare è un metallocene. L'osmocene è disponibile in commercio e in condizioni normali è un solido di colore bianco. In questo composto l'osmio ha formalmente stato di ossidazione +2.[2][4]
Struttura
La struttura dell'osmocene è quella di un composto a sandwich, con l'atomo di osmio racchiuso tra due anelli ciclopentadienilici. È una struttura analoga a quella del rutenocene, con i due anelli aromatici in configurazione eclissata (simmetria D5h), mentre nel ferrocene hanno configurazione sfalsata (simmetria D5d).[4]
In solido l'osmocene mostra struttura cristallina ortorombica, gruppo spaziale Pnma, con costanti di reticolo a = 707,9 pm, b = 890,8 pm e c = 1277,1 pm, quattro unità di formula per cella elementare. La distanza media Os-C risulta 219 pm, molto simile a quella Ru-C del rutenocene (218,6 pm).[1]
Sintesi
L'osmocene fu sintetizzato per la prima volta nel 1959 da Ernst Otto Fischer trattando tetracloruro di osmio con un eccesso di ciclopentadienuro di sodio.[5] Si può ottenere anche trattando tetrossido di osmio con acido bromidrico, e successiva reazione con zinco e ciclopentadiene.[1]
Reattività
L'osmocene è un composto stabile fino a 540 ºC.[5] Dà luogo a reazioni di sostituzione elettrofila, analogamente a ferrocene e rutenocene. La reattività cala nell'ordine ferrocene > rutenocene > osmocene.[6] Di contro, dei tre è l'osmocene quello che forma più facilmente addotti con acidi di Lewis tipo Cp2Os•HgCl2.[7]
Per ossidazione dell'osmocene si forma un dimero contenente un legame osmio-osmio.[8]
Note
Bibliografia
- (EN) J. C. A. Bobyens, D. C. Levendis, M. I. Bruce e M. L. Williams, Crystal structure of osmocene, Os(η-C5H5)2, in Journal of Crystallographic and Spectroscopic Research, vol. 16, 1986, pp. 519–524, DOI:10.1007/BF01161040.
- (EN) M. W. Droege, W. D. Harman e H. Taube, Higher oxidation state chemistry of osmocene: dimeric nature of the osmocenium ion, in Inorg. Chem., vol. 26, n. 8, 1987, pp. 1309-1315, DOI:10.1021/ic00255a023.
- (DE) E. O. Fischer e H. Grubert, Über Aromatenkomplexe von Metallen, XXIX. Di‐cyclopentadienyl‐osmium, in Chem. Ber., vol. 92, n. 9, 1959, pp. 2302-2309, DOI:10.1002/cber.19590920948.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (EN) S. A. Kur, A. L. Rheingold e C. H. Winter, Synthesis, Characterization, and Halogenation of Decakis(acetoxymercurio)osmocene. Crystal and Molecular Structure of Decachloroosmocene, in Inorg. Chem., vol. 34, n. 1, 1995, pp. 414-416, DOI:10.1021/ic00105a067.
- (EN) P. A. Shapley, Osmium: Organometallic Chemistry, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia172, ISBN 9780470862100.
- (EN) M. D. Rausch, E. O. Fischer e H. Grubert, The Aromatic Reactivity of Ferrocene, Ruthenocene and Osmocene, in J. Am. Chem. Soc., vol. 82, n. 1, 1960, pp. 76-82, DOI:10.1021/ja01486a016.
- STREM Chemicals, Safety Data Sheet (PDF), su strem.com, 2016. URL consultato il 29 gennaio 2020.
Altri progetti
Altri progetti
- Wikimedia Commons
 Wikimedia Commons contiene immagini o altri file su Osmocene
Wikimedia Commons contiene immagini o altri file su Osmocene
 Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia
Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia






