Ossammide
| Ossammide | |
|---|---|
 | |
 | |
| Nomi alternativi | |
| etanodiammide | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C2H4N2O2 |
| Massa molecolare (u) | 88,0654 |
| Aspetto | polvere bianca |
| Numero CAS | 471-46-5 |
| Numero EINECS | 207-442-5 |
| PubChem | 10113 |
| SMILES | C(=O)(C(=O)N)N |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,667[1] |
| Solubilità in acqua | 0,3 g/L a 20 ºC[2] |
| Temperatura di fusione | ≈350 °C (623 K) dec.[2] |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | -504,4[1] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 | |
| attenzione | |
| Frasi H | 302 - 315 - 319 [3] |
| Consigli P | 305+351+338 [3] |
| Modifica dati su Wikidata · Manuale | |
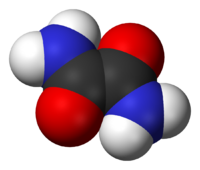
L'ossammide è il composto organico di formula (CONH2)2. In condizioni normali è un solido cristallino bianco. È solubile in etanolo, poco solubile in acqua e insolubile in etere etilico. L'ossammide è la diammide dell'acido ossalico.
Storia
L'ossammide fu sintetizzata per la prima volta nel 1830 da Jean Baptiste Dumas.[4] Nel 1859 Justus von Liebig la preparò da cianogeno e acqua, usando acetaldeide come catalizzatore.[5] Nel 1913 il biochimico tedesco Walter Löb la ottenne trattando vapori di formammide con una scarica elettrica.[6]
Sintesi
L'ossammide viene sintetizzata industrialmente per ossidazione catalitica del cianuro di idrogeno. La reazione è praticamente quantitativa e senza particolari trattamenti si ottiene ossammide pura al 99%.[2]
Usi
L'ossammide è usata principalmente come fertilizzante azotato a lento rilascio, col vantaggio che per la sua scarsa solubilità non viene dilavato dal terreno con la pioggia, come avviene con altri fertilizzanti azotati tipo urea e solfato d'ammonio.[7] È impiegata inoltre come materiale di partenza per la sintesi di altri composti organici.[2]
Tossicità / Indicazioni di sicurezza
L'ossammide può provocare irritazioni agli occhi e alla pelle, ed è nociva se ingerita. Non ci sono dati che indichino proprietà cancerogene.[3]
Note
- ^ a b Lide 2005
- ^ a b c d Riemenschneider 2002
- ^ a b c Sigma-Aldrich
- ^ Dumas 1830
- ^ von Liebig 1860
- ^ Löb 1913
- ^ Sawada e Murakami 1998
Bibliografia
- (DE) J. Dumas, Ueber das Oxamid, eine gewissen Thierstoffen verwandte Substanz, in Ann. Phys., vol. 95, n. 8, 1830, pp. 474–487, DOI:10.1002/andp.18300950803.
- D. R. Lide (Editor), CRC Handbook of Chemistry and Physics, Internet Version 2005, su hbcponline.com, CRC Press, Boca Raton, 2005. URL consultato il 9 dicembre 2017.
- (DE) W. Löb, Über das Verhalten des Formamids unter der Wirkung der stillen Entladung Ein Beitrag zur Frage der Stickstoff-Assimilation, in Ber. Dtsch. Chem. Ges., vol. 46, n. 1, 1913, pp. 684-697, DOI:10.1002/cber.19130460193.
- (EN) W. Riemenschneider, Oxalic acid, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a18_247.
- (EN) H. Sawada e T. Murakami, Oxalic acid, in Kirk-Othmer Encyclopedia of Chemical Technology, 4ª ed., John Wiley & Sons, 1998.
- Sigma-Aldrich, Scheda di dati di sicurezza dell'ossammide, su sigmaaldrich.com, 2013. URL consultato l'8 dicembre 2017.
- J. von Liebig, Ueber die Bildung des Oxamids aus Cyan, in Justus Liebigs Ann. Chem., vol. 113, n. 2, 1860, pp. 246–247, DOI:10.1002/jlac.18601130213. URL consultato il 3 aprile 2014.
Altri progetti
Altri progetti
- Wikimedia Commons
 Wikimedia Commons contiene immagini o altri file su Ossammide
Wikimedia Commons contiene immagini o altri file su Ossammide
| Controllo di autorità | GND (DE) 4413479-4 |
|---|
 Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia
Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia











