過臭素酸
| 過臭素酸 | |
|---|---|
 |  |
過臭素酸 | |
| 識別情報 | |
| CAS登録番号 | 19445-25-1 |
| |
| 特性 | |
| 化学式 | HBrO4 |
| モル質量 | 144.91 g mol-1 |
| 外観 | 無色の水溶液 |
| 水への溶解度 | 混和 |
| 酸解離定数 pKa | - |
| 関連する物質 | |
| その他の陰イオン | セレン酸;ヒ酸;ゲルマニウム酸 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
過臭素酸(かしゅうそさん、perbromic acid)とは、臭素のオキソ酸の一種で、化学式 HBrO4 の化合物である。臭素原子の酸化数は最高酸化状態の+VII(+7)である。名称に「過」と付いているものの分子内に-O-O-結合はなく過酸ではない。
概要
形式的には七酸化二臭素(Br2O7)と水が反応してできることになるが、この七酸化二臭素自体、現在のところ安定には得られていない。過臭素酸は不安定な強酸で、過塩素酸に性質が似ている。また、強い酸化力がある。遊離状態の純粋な酸はまだ得られていない。
かつては過臭素酸および過臭素酸イオンは存在しないとされ、存在しない理由を理論的に説明する学術論文まで出される始末であったが、1968年にようやく合成されるに至った[1]。
製法
最初は放射性同位体のセレン原子を含むセレン酸イオンのβ崩壊により過臭素酸イオンの生成が見出された[2]。
化学実験室レベルの合成としては、臭素酸塩を二フッ化キセノンで酸化する方法もあるが、濃厚臭素酸ナトリウム水溶液を塩基性条件で、冷却しながらフッ素により酸化させる方法が実用的である[3]。
得られた溶液から、未反応の臭素酸イオンを臭素酸銀(AgBrO3)として、フッ化物イオンをフッ化カルシウム(CaF2)の沈殿として除き、陽イオン交換樹脂を通して遊離酸の水溶液を得る。
化学的性質
過臭素酸イオンは熱力学的に不安定であり、極めて強い酸化剤であるが、反応速度論的には比較的安定している。その酸性水溶液中における標準酸化還元電位は以下の通りである。
過臭素酸の水溶液を減圧濃縮することも可能であり、6mol dm-3(約55%)程度までの水溶液は100℃以下であれば比較的安定で、さらに減圧濃縮し12mol dm-3(約80%)程度の水溶液および2水和物()の結晶も得られるが不安定であり、塩化物イオンを酸化し有機物と接触すると爆発的に燃焼する[1][3]。
また水溶液中では過塩素酸と同様に著しい強酸である。
過臭素酸イオン
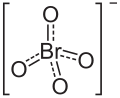

過臭素酸イオン(かしゅうそさんいおん、perbromate, BrO4-)は過臭素酸の電離により生成し、また過臭素酸塩中に存在する1価の陰イオンであり、過塩素酸イオンと同様に正四面体型構造でBr-O結合距離は161pmである。
過臭素酸塩
過臭素酸塩(かしゅうそさんえん、perbromate)は過臭素酸イオンを含むイオン結晶であり、過臭素酸カリウムは比較的安定で275℃で分解して酸素を放ち臭素酸カリウム(KBrO3)となり、過臭素酸アンモニウムも175℃まで安定である[1]。
- 過臭素酸アンモニウム (NH4BrO4)
- 過臭素酸カリウム (KBrO4)
- 過臭素酸カルシウム (Ca(BrO4)2)
- 過臭素酸ナトリウム (NaBrO4)
参考文献
- ^ a b c FA コットン, G. ウィルキンソン著, 中原 勝儼訳 『コットン・ウィルキンソン無機化学』 培風館、1987年,原書:F. ALBERT COTTON and GEOFFREY WILKINSON, Cotton and Wilkinson ADVANCED INORGANIC CHEMISTRY A COMPREHENSIVE TEXT Fourth Edition, INTERSCIENCE, 1980.
- ^ 『化学辞典』 東京化学同人、1994年
- ^ a b 日本化学会編 『新実験化学講座 無機化合物の合成I』 丸善、1977年
関連項目
| |||
|---|---|---|---|
| 二元化合物 | |||
| 多元化合物 |
| ||
| | |||
- 表示
- 編集
![{\displaystyle {\ce {^{83}SeO4^{2-}\ ->[\beta -]\ ^{83}BrO4^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/709d471ad2716d03ce308d0f4af6dd3a0c0f6e44)













