Cyklooktatetraen
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Ogólne informacje | ||||||||||||||||||||||||||||
| Wzór sumaryczny | C8H8 | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 104,06 g/mol | |||||||||||||||||||||||||||
| Wygląd | przezroczysta bezbarwna lub żółta ciecz[1] | |||||||||||||||||||||||||||
| Identyfikacja | ||||||||||||||||||||||||||||
| Numer CAS | 629-20-9 | |||||||||||||||||||||||||||
| PubChem | 637866 | |||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Podobne związki | ||||||||||||||||||||||||||||
| Podobne związki | cyklooktan | |||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Cyklooktatetraen – organiczny związek chemiczny, cykliczny węglowodór ze sprzężonymi wiązaniami podwójnymi z grupy polienów. Nie jest aromatyczny, ponieważ nie spełnia reguły Hückla.
Historia
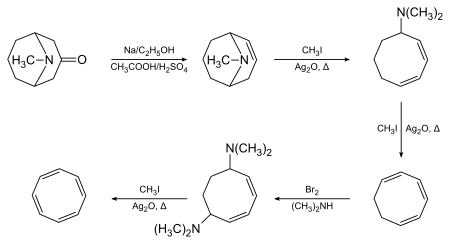
Cyklooktatetraen został po raz pierwszy wytworzony przez Richarda Willstättera w 1905 roku w wyniku eliminacji Hofmanna pseudopelletieryny[3][4]:
Struktura

Podczas pierwszych badań stało się jasne, że reaktywność cyklooktatetraenu nie odpowiada chemii związków aromatycznych[5]. Eksperymenty oparte na dyfrakcji elektronów wykazały, że wszystkie długości wiązań węgiel–węgiel są takie same, a wszystkie kąty C−C−C mają 120°, sugerując znacznystopień rezonancu i konformację koronową[6]. Wkrótce jednak wyniki badań rentgenograficznych wykazały, że danym eksperymentalnym najlepiej odpowiada konformacja łódkowa, z naprzemiennie występującymi wiązaniami pojedynczymi (1,54 Å) i podwójnymi (1,34 Å) i kątami C=C−C wynoszącymi 125°[7].
Występowanie
Cykooktatetraen został wyizolowany z niektórych grzybów[8].
Przypisy
- ↑ a b c d e f g Cyclooctatetraene, [w:] PubChem [online], United States National Library of Medicine, CID: 637866 [dostęp 2024-09-03] (ang.).
- ↑ Cyclooctatetraene [online], karta charakterystyki produktu Sigma-Aldrich, 25 kwietnia 2024, numer katalogowy: 138924 [dostęp 2024-09-04] . (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Stephen F.S.F. Mason Stephen F.S.F., The science and humanism of Linus Pauling (1901–1994), „Chem. Soc. Rev.”, 26 (1), 1997, s. 29–39, DOI: 10.1039/CS9972600029 (ang.).
- ↑ RichardR. Willstätter RichardR., ErnstE. Waser ErnstE., Über Cyclo-octatetraen, „Berichte der deutschen chemischen Gesellschaft”, 44 (3), 1911, s. 3423–3445, DOI: 10.1002/cber.191104403216 (niem.).
- ↑ A.W.A.W. Johnson A.W.A.W., Organic Chemistry, „Science Progress”, 35 (139), 1947, s. 506–515, JSTOR: 43413011 (ang.).
- ↑ O.O. Bastiansen O.O., O.O. Hassel O.O., A.A. Langseth A.A., The ‘Octa-Benzene’, Cyclo-octatetraene (C8H8), „Nature”, 160 (4056), 1947, s. 128–128, DOI: 10.1038/160128a0 (ang.).
- ↑ H.S.H.S. Kaufman H.S.H.S., I.I. Fankuchen I.I., H.H. Mark H.H., Structure of Cyclo-octatetraene, „Nature”, 161 (4083), 1948, s. 165–165, DOI: 10.1038/161165a0 (ang.).
- ↑ MerrittM. Stinson MerrittM. i inni, An endophytic Gliocladium sp. of Eucryphia cordifolia producing selective volatile antimicrobial compounds, „Plant Science”, 165 (4), 2003, s. 913–922, DOI: 10.1016/S0168-9452(03)00299-1 (ang.).
- GND: 4148569-5
- NDL: 00570979
- Britannica: science/cyclooctatetraene