Guzak
| Meloidogyne | |||
| Goeldi, 1892 | |||
 Guzak południowy (Meloidogyne incognita) | |||
| Systematyka | |||
| Domena | eukarionty | ||
|---|---|---|---|
| Królestwo | zwierzęta | ||
| Typ | nicienie | ||
| Gromada | Chromadorea | ||
| Rząd | Rhabditidia | ||
| Podrząd | Tylenchina | ||
| Infrarząd | Tylenchomorpha | ||
| Nadrodzina | Tylenchoidea | ||
| Rodzina | Meloidogynidae | ||
| Rodzaj | guzak | ||
| Typ nomenklatoryczny | |||
| Meloidogyne exigua Göldi, 1887 | |||
| Synonimy | |||
| |||
| |||
| |||
Guzak[1] (Meloidogyne) – rodzaj nicieni z rodziny Meloidogynidae. Obejmuje obligatoryjne endopasożyty różnorodnych roślin naczyniowych, atakujące najczęściej ich organy podziemne. Większość gatunków wywołuje powstawanie na żywicielach galasów. Zakaźne jest drugie stadium młodociane. Wędrujące są również dorosłe samce. Dorosłe samice oraz trzecie i czwarte stadium młodociane są osiadłe. Dotychczas opisano ich około 100 gatunków.
Rodzaj kosmopolityczny, najliczniej reprezentowany w strefie tropikalnej i ciepłej umiarkowanej[2]. Dziesięć gatunków ma istotne znaczenie gospodarcze jako szkodniki roślin uprawnych, a cztery spośród nich zyskały na terenach rolniczych zasięg kosmopolityczny[3].
Morfologia

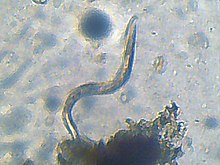
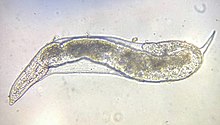

Nicienie te osiągają do 3 mm długości[3]. Oskórek mają pierścieniowany, wskutek występowania okrężnych rowków. W części labialnej występuje do czterech pierścieni. Sześciopromienisty szkielet głowowy jest umiarkowanie zesklerotyzowany. Gruczoły gardzielowe są długie, sięgające ponad jelito, a grzbietowe z nich uchodzą tuż za nasadą sztyletu. Występuje silny dymorfizm płciowy, związany z odmiennym trybem życia obu płci. Rowkowanie oskórka na, najczęściej spłaszczonym, perineum tworzy wzór przypominający odcisk palca[4].
Samica
Samica jest osiadła. Ciało ma wzdęte, kształtu gruszkowatego do okrągłego[4][3], ubarwione perłowo biało[1], osiągające od 350 do 3000 μm długości[3]. Dysk wargowy jest grzbieto-brzusznie wydłużony[4], spłaszczony do nieco wyniesionego, przyrośnięty do wargi środkowej i warg bocznych[3], zaopatrzony w drobny, okrągły otwór gębowy otoczony przez sześć wewnętrznych dołeczków wargowych o funkcji zmysłowej[4]. Na części głowowej występują dwa szczeliniaste amfidie[3]. Sztylet jest delikatny[3], smukły[4], długości 10–25 μm[1] (najczęściej 12–15 μm[4]), u większości gatunków zagięty na stronę grzbietową[3]. Trzon sztyletu jest prosty, zaopatrzony w trzy małe guziki[1][3]. Ujście grzbietowego gruczołu gardzielowego leży od 2,5 do 9 μm od guzików[3]. Wulwy i odbyt położone są terminalnie na tylnym końcu ciała i blisko siebie[4][3]. Fasmidie mają formę kropek. Położone są tuż przed odbytem oraz po każdym jego boku. Drogi płciowe są parzyste, poskręcane, o macicach skierowanych ku przodowi i ustawionych równolegle do siebie (prodelficzne)[4]. Jaja w większości leżą w woreczku utworzonym z galaretowatej wydzieliny sześciu dużych gruczołów rektalnych[4][3].
Samiec
Samiec jest wędrowny. Ciało ma robakowate, silnie pierścieniowane z czterema wcięciami na polach bocznych[4][3], osiągające od 600 do 2500 μm długości[3]. Część wargowa ma wyraźny, zaokrąglony dysk wargowy z czterema zrośniętymi wargami środkowymi i otwór gębowy otoczony przez sześć wewnętrznych dołeczków wargowych o funkcji zmysłowej[4][3]. Liczba pierścieni na części wargowej wynosi od 1 do 3. Szkielecik głowowy ma sektory boczne szersze od submedialnych i formujące „policzki”[4]. Dwa duże, szczelinowate amfidie zlokalizowane są między dyskiem wargowym a wargami bocznymi[3]. Prosty, tęgi sztylet ma od 13 do 36 μm długości (najczęściej 18–25 μm[4]). Trzon sztyletu zaopatrzony jest w trzy guziki[3] o zmiennym kształcie[1]. Ujście grzbietowego gruczołu gardzielowego leży od 2 do 13 μm od guzików[3]. Gruczoły gardzielowe leżą głównie brzusznie względem jelita. Typowo występuje tylko jedno jądro, ale w przypadku osobników po zmianie płci obecne są dwa. W układzie rozrodczym nie występuje torebka kopulacyjna[4]. Ogon jest krótki[3], ze skręconą częścią końcową[4] i tępo zaokrąglonym wierzchołkiem; ma smukłe spikule o długości od 20 do 40 μm[3] i wodzidło o długości od 7 do 11 μm. Stek położony jest na ogonie przedkońcowo, a kropkowate fasmidie leżą w pobliżu jego ujścia[4].
Stadia rozwojowe
Pierwsze stadium linieje wewnątrz jaja[4].
Drugie stadium jest wędrowne i zakaźne. Ciało ma robakowate[4][3], długości od 250 do 600 μm[3]. Część głowowa jest wykształcona podobnie jak u samców, jednak jej szkielecik jest delikatniejszy i słabiej zesklerotyzowany[4][3]. Liczba pierścieni w rejonie wargowym może wynosić od jednego do czterech[4]. Sztylet jest prosty, delikatny i osiąga od 9 do 16 μm długości, a ujście grzbietowego gruczołu gardzielowego leży od 2 do 12 μm od guzików. Trzy gruczoły gardzielowe zachodzą od brzusznej strony na jelito[3]. Środkowa nabrzmiałość gardzieli ma duże, owalne zgrubienia załamujące światło[4]. Ogon ma od 15 do 100 μm długości, z których 5–30 μm przypada na jego przezroczysty odcinek[1][3]. Wierzchołek ogona jest wąski[4].
Drugie i trzecie linienie zachodzi w egzuwium drugiego stadium. Stadia trzecie i czwarte są osiadłe, o kiełbaskowatym ciele z odbytem umieszczonym na tylnym końcu i pozbawionym sztyletu[4][3].
Biologia i ekologia



Wszystkie gatunki są obligatoryjnymi pasożytami wewnętrznymi roślin[3]. Do ich gospodarzy należą niemal wszystkie gatunki roślin naczyniowych[2].
Stadium zakaźnym jest osobnik młodociany po pierwszym linieniu[4][3]. Po opuszczeniu wędruje w glebie poszukując żywiciela. Wnika do niego przez wierzchołek korzenia, po czym przemieszcza się międzykomórkowo do atakowanego organu. Tam wstrzykuje sztyletami w kilka komórek wydzielinę gruczołów gardzielowych, indukując tworzenie się galasu[3]. Najczęściej atakowane są korzenie i inne organy podziemne, jednak znane są gatunki tworzące galasy na łodygach, liściach i kwiatach, a nieliczne, jak M. sasseri, żerują bez wytwarzania galasów[4].
Po zakończeniu żerowania drugie stadium linieje do trzeciego, a potem do czwartego – oba są osiadłe i nie pobierają pokarmu, a w ich trakcie następuje rozwój gonad[3]. Nie występuje stadium cysty[4].
Płeć osobnika determinowana jest przez czynniki środowiskowe i na różnych etapach rozwoju może dojść do przekształcenia samicy w samca. W zależności od etapu, na którym dojdzie do odwrócenia płci, samiec może mieć jedno jądro, dwa jądra, z których jedno jest uwstecznione, lub dwa w pełni wykształcone jądra[5]. Laboratoryjnie zmianę płci indukować można za pomocą testosteronu[6]. Stadia dorosłe przejawiają silny dymorfizm płciowy. Samce nie żerują, lecz opuszczają żywiciela w poszukiwaniu partnerki. Samice natomiast pozostają osiadłe i pobierając pokarm szybko rosną. Jaja wytwarzać mogą przez okres do 2–3 miesięcy, a ich łączna liczba sięga od 100 do 1000[3]. W przypadku braku samców możliwa jest telitokia[5]. W optymalnej temperaturze cykl życiowy może zostać zakończony w 3 tygodnie[3].
Taksonomia
Rodzaj ten wprowadzony został w 1892 roku przez Émila Augusta Goeldiego[7][8][4]. Nazwa rodzajowa oznacza „samica w kształcie jabłka” (gr. μηλον mēlon „owoc”, zwłaszcza „jabłko”; ειδoς eidos „forma, kształt”; γυνη gunē, γυναικος gunaikos „żona, kobieta, samica”[9]) i odnosi się do morfologii tej płci[3]. Początkowo klasyfikowano go w rodzinie mątwikowatych. W 1959 roku T.S. Skarbilowicz wprowadził dla niego monotypową podrodzinę Meloidogyninae w obrębie mątwikowatych[10]. Różni autorzy w drugiej połowie XX wieku kwestionowali monofiletyzm tak rozumianych mątwikowatych[3]. Ponadto w roku 1974 oraz 1985 wprowadzono dwa nowe rodzaje Meloidogyninae, odpowiednio Meloinema i Bursadera. Od 1987 roku zaczęto Meloidogyninae wynosić do rangi osobnej rodziny Meloidogynidae. Alternatywnie traktuje się ją jako podrodzinę w obrębie Hoplolaimidae[4].
Obejmuje około 100 opisanych gatunków[2], w tym[4]:
- Meloidogyne acronea Coetzee, 1956
- Meloidogyne actinidiae Li & Yu, 1991
- Meloidogyne africana Whitehead, 1960
- Meloidogyne aquatilis Ebsary & Eveleigh, 1983
- Meloidogyne arabicida López & Salazar, 1989
- Meloidogyne ardenensis Santos, 1968
- Meloidogyne arenaria (Neal, 1889) Chitwood, 1949
- Meloidogyne artiellia Franklin, 1961
- Meloidogyne baetica Castillo, Vovlas, Subbotin & Troccoli, 2003
- Meloidogyne brasilensis Charchar & Eisenback, 2002
- Meloidogyne brevicauda Loos, 1953
- Meloidogyne californiensis Abdel-Rahman & Maggenti, 1987
- Meloidogyne camelliae Golden, 1979
- Meloidogyne caraganae Shagalina, Ivanova & Krall, 1985
- Meloidogyne carolinensis Eisenback, 1982
- Meloidogyne chitwoodi Golden et al., 1980 – guzak amerykański
- Meloidogyne chosenia Eroshenko & Lebedeva, 1992
- Meloidogyne christiei Golden & Kaplan, 1986
- Meloidogyne cirricauda Zhang & Weng, 1991
- Meloidogyne citri Zhang, Gao & Weng, 1990
- Meloidogyne coffeicola Lordello & Zamith, 1960
- Meloidogyne cruciani García-Martinez, Taylor & Smart, 1982
- Meloidogyne cynariensis Pham,4 1990
- Meloidogyne decalineata Whitehead, 1968
- Meloidogyne donghaiensis Zheng, Lin & Zheng, 1990
- Meloidogyne dunensis Paolomaes Rius et al., 2007
- Meloidogyne duytsi Karssen, van Aelst & van der Putten, 1998
- Meloidogyne enterolobii Yang & Eisenback, 1983
- Meloidogyne ethiopica Whitehead, 1968
- Meloidogyne exigua Göldi, 1887
- Meloidogyne fallax Karssen, 1996 – guzak holenderski
- Meloidogyne fanzhiensis Chen, Peng & Zheng, 1990
- Meloidogyne floridensis Handoo et al., 2004
- Meloidogyne fujianensis Pan, 1985
- Meloidogyne graminicola Golden & Birchfield, 1965
- Meloidogyne graminis (Sledge & Golden, 1964)
- Meloidogyne hainanensis Liao & Feng, 1995
- Meloidogyne hapla Chitwood, 1949 – guzak północny
- Meloidogyne haplanaria Eisenback et al., 2004
- Meloidogyne hispanica Hirschmann, 1986
- Meloidogyne ichinohei Araki, 1992
- Meloidogyne incognita (Kofoid & White, 1919) – guzak południowy
- Meloidogyne indica Whitehead, 1968
- Meloidogyne inornata Lordello, 1956a
- Meloidogyne izalcoensis Carneiro, Almeida, Gomes & Hernández, 2005
- Meloidogyne javanica (Treub, 1885) Chitwood, 1949
- Meloidogyne jianyangensis Yang, Hu, Chen & Zhu, 1990
- Meloidogyne jinanensis Zhang & Su, 1986
- Meloidogyne kikuyensis De Grisse, 1961
- Meloidogyne konaensis Eisenback, Bernard & Schmitt, 1995
- Meloidogyne kongi Yang, Wang & Feng, 1988
- Meloidogyne kralli Jepson, 1984
- Meloidogyne lini Yang, Hu & Xu, 1988
- Meloidogyne lusitanica Abrantes & Santos, 1991
- Meloidogyne mali Itoh, Ohshima & Ichinohe, 1969
- Meloidogyne maritima Jepson, 1987
- Meloidogyne marylandi Jepson & Golden in Jepson, 1987
- Meloidogyne megadora Whitehead, 1968
- Meloidogyne megatyla Baldwin & Sasser, 1979
- Meloidogyne mersa Siddiqi & Booth, 1991
- Meloidogyne microcephalus Cliff & Hirschmann, 1984
- Meloidogyne microtyla Mulvey, Townshend & Potter, 1975
- Meloidogyne mingnanica Zhang, 1993
- Meloidogyne minor Karssen et al., 2004
- Meloidogyne morocciensis Rammah & Hirschmann, 1990
- Meloidogyne naasi Franklin, 1965a
- Meloidogyne nataliae Golden, Rose & Bird, 1981
- Meloidogyne oryzae Maas, Sanders & Dede, 1978
- Meloidogyne oteifai6 Elmiligy, 1968
- Meloidogyne ottersoni (Thorne, 1969) Franklin, 1971
- Meloidogyne ovalis Riffle, 1963
- Meloidogyne panyuensis Liao, Yang, Feng & Karssen, 2005
- Meloidogyne paranaensis Carneiro et al., 1996
- Meloidogyne partityla Kleynhans, 1986b
- Meloidogyne petuniae Charchar, Eisenback & Hirschmann, 1999
- Meloidogyne phaseoli Charchar et al., 2008b
- Meloidogyne pini Eisenback, Yang & Hartman, 1985
- Meloidogyne piperi Sahoo, Ganguly & Eapen, 2000
- Meloidogyne pisi Charchar et al., 2008a
- Meloidogyne platani Hirschmann, 1982
- Meloidogyne propora Spaull, 1977
- Meloidogyne querciana Golden, 1979
- Meloidogyne salasi López, 1984
- Meloidogyne sasseri Handoo, Huettel & Golden, 1994
- Meloidogyne sewelli Mulvey & Anderson, 1980
- Meloidogyne silvestris Castillo et al., 2009
- Meloidogyne sinensis Zhang, 1983
- Meloidogyne spartinae (Rau & Fassuliotis, 1965)
- Meloidogyne subarctica Bernard, 1981
- Meloidogyne suginamiensis Toida & Yaegashi, 1984
- Meloidogyne tadshikistanic a Kirjanova & Ivanova, 1965
- Meloidogyne thailandica Handoo, Skantar, Carta & Erbe, 2005
- Meloidogyne trifoliophila Bernard & Eisenback, 1997
- Meloidogyne triticoryzae Gaur, Saha & Khan, 1993
- Meloidogyne turkestanica Shagalina, Ivanova & Krall, 1985
- Meloidogyne ulmi Marinari-Palmisano & Ambrogioni, 2000
- Meloidogyne vandervegtei Kleynhans, 1988
Przypisy
- ↑ a b c d e f Europejska i Śródziemnomorska Organizacja Ochrony Roślin. Diagnostyka. Meloidogyne chitwoodi i Meloidogyne fallax. „Bulletin OEPP/EPPO”. 39, s. 5-17, 2009.
- ↑ a b c Sergio Álvarez-Ortega, Janete A. Brito, Sergei. A. Subbotin. Multigene phylogeny of root-knot nematodes and molecular characterization of Meloidogyne nataliei Golden, Rose & Bird, 1981 (Nematoda: Tylenchida). „Scientific Reports”. 9, 2019.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah Gerrit Karssen: The Plant Parasitic Nematode Genus Meloidogyne Göldi, 1892 (Tylenchida) in Europe. Leiden, Boston, Koln: Brill, 2002.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac David J. Hunt ZafarD.J.H.Z. Handoo David J. Hunt ZafarD.J.H.Z., 3. Taxonomy, identification and principal species, [w:] R.N.R.N. Perry, M.M. Moens, J.L.J.L. Starr (red.), Root-knot Nematodes, CAB International, 2009, DOI: 10.1079/9781845934927.0055 .
- ↑ a b Joanna Papadopulou, A. C. Triantaphyllou. Sex Differentiation in Meloidogyne incognita and Anatomical Evidence of Sex Reversal. „Journal of Nematology”. 14 (4), s. 549-566, 1982.
- ↑ Gamalat Y. Osman. Preliminary study on induction of sex reversal inMeloidogyne javanica (Chitwood) andTylenchulus semipenetrans (Cobb) nematodes by testosterone. „Anzeiger für Schädlingskunde, Pflanzenschutz, Umweltschutz”. 63, s. 14–15, 1990.
- ↑ É. Goeldi. Biologische Miscellen aus Brasilien. VII. Der Kaffeenematode Brasiliens (Meloidogyne exigua G.). „Zoologische Jahrbücher”. Abteilung für Systematik, Geographie und Biologie der Tiere. 4, s. 262, 1889. (niem.).
- ↑ Bezerra, T.N.; Decraemer, W.; Eisendle-Flöckner, U.; Hodda, M.; Holovachov, O.; Leduc, D.; Miljutin, D.; Mokievsky, V.; Peña Santiago, R.; Sharma, J.; Smol, N.; Tchesunov, A.; Venekey, V.; Zhao, Z.; Vanreusel, A.: Meloidogyne Goeldi, 1892. [w:] Nemys: World Database of Nematodes (World Register of Marine Species) [on-line]. [dostęp 2020-03-09].
- ↑ Edmund C.E.C. Jaeger Edmund C.E.C., Source-book of biological names and terms, wyd. 1, Springfield: Charles C. Thomas, 1944, 79, 100, 133, OCLC 637083062 (ang.).
- ↑ T.S. Skarbilovich. On the structure of systematics of nematodes order Tylenchida Thorne, 1949. „Acta Parasitologica”. 7, s. 117–132, 1959.
- NKC: ph527851
- Britannica: animal/root-knot-nematode
- БРЭ: 2341958











