Reakcja Ugiego

Reakcja Ugiego – wieloskładnikowa reakcja chemiczna w chemii organicznej. Reakcja zachodzi między ketonem lub aldehydem a aminą, izonitrylem i kwasem karboksylowym tworząc amid[1][2][3]. Nazwa reakcji pochodzi od nazwiska Ivara Ugiego, który odkrył ją w 1959 roku.
Reakcja Ugiego jest egzotermiczna, a jej szybkość zależy od szybkości wkraplania izonitrylu. Wysokie stężenie (0,5–2,0 M) reagentów daje najwyższe wydajności. Reakcję prowadzi się w rozpuszczalnikach polarnych, aprotycznych np. DMF. Jako rozpuszczalnik można także, z powodzeniem, stosować niektóre rozpuszczalniki polarne i protyczne jak metanol czy etanol. Reakcja nie wymaga stosowania katalizatora. Badania dowiodły, iż powstająca jako produkt uboczny cząsteczka wody przyspiesza reakcję[4][5][6][7][8][9][10][11].
Mechanizm reakcji
W pierwszym etapie reakcji z aminy i ketonu powstaje imina (1). Następcza reakcji iminy z izonitrylem i kwasem karboksylowym daje produkt przejściowy 2, który przegrupowuje się do amidu 3. Dokładny mechanizm powstawania produktu pośredniego 2 nie jest znany.

Reakcję można także przeprowadzić używając jako substratu iminy, bez konieczności jej syntezowania.
Jeden z postulowanych mechanizmów reakcji przedstawiono poniżej[12].

Amina 1 i keton 2 tworzą iminę 3 oraz jedną cząsteczkę wody. W kolejnej reakcji elementarnej następuje wymiana protonu z kwasu karboksylowego 4 w wyniku czego powstaje jon iminowy 5, który w wyniku addycji nukleofilowej przyłącza izonitryl 6. Przyłączenie następuje pomiędzy terminalnym atomem węgla w izonitrylu i atomem węgla z grupy iminowej. Do powstałego kationu przejściowego 7, w wyniku kolejnej addycji nukleofilowej, przyłącza się reszta kwasu karboksylowego, dając kolejny produkt przejściowy 8. Ostatnim etapem jest przegrupowanie Mumma z przeniesieniem grupy acylowej przy podstawniku R4 z atomu tlenu na atom azotu. Wszystkie etapy, poza przegrupowaniem Mumma, są odwracalne.
Odmiany
Połączenie różnych substratów
Używając bifunkcyjnych substratów znacznie zwiększa się różnorodność możliwych produktów reakcji. Reakcję Ugiego można połączyć z wewnątrzcząsteczkową reakcją Dielsa-Aldera[13].
W przypadku, gdy zamiast kwasu karboksylowego zastosuje się fenol, ostatni etap, którym jest przegrupowanie Mumma, zostanie zastąpiony przegrupowaniem Smilego[14].
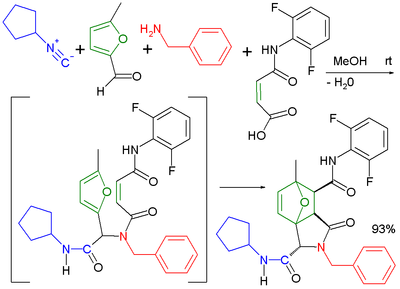 | 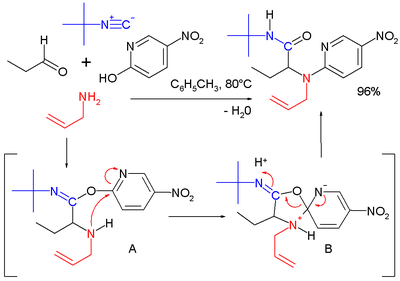 | |
| Połączenie reakcji Ugiego i Dielsa Aldera | Połączenie reakcji Ugiego i Smilego |
Kolejnym przykładem, w którym połączono dwie reakcje jest kombinacja z reakcją Buchwalda-Hartwiga[15]. W połączeniu Ugi-Heck, reakcja Hecka zachodzi w drugim etapie syntezy[16].
 |  | |
| Połączenie reakcji Ugiego i Buchwalda-Hartwiga | Połączenie reakcji Ugiego i Hecka |
Połączenie kwasu i aminy w jeden związek
Zastosowanie β-aminokwasu daje β-laktam[17]. Połączenie to opiera się na transferze grupy acylowej, w przegrupowaniu Mumma, z utworzeniem czteroczłonowego pierścienia. Reakcja taka zachodzi w temperaturze pokojowej w metanolu. Przykładowo p-nitrobenzaldehyd tworzy w tej reakcji β-laktampokaany na rysunku z wydajnością 71%. Powstaje mieszanina dwóch stereoizomerów w stosunku 4:1.

Połączenie grupy karbonylowej i karboksylowej w jeden związek
Możliwe jest przeprowadzenie reakcji, w której grupy acylowa i karboksylowa znajdują się w jednej cząsteczce. Wynikiem tej reakcji są laktamy o różnej wielkości pierścienia[18][19].
Zastosowanie
Synteza chemiczna
Reakcja Ugiego daje możliwość syntezy ogromnej ilości nowych związków chemicznych, stosując różne ketony, aldehydy, kwasy i izonitryle. Otrzymane substancje mogą okazać się przydatne w opracowaniu nowych substancji aktywnych farmaceutycznie. Jedyną wadą jest brak różnorodności produktów, jednak połączenie tej reakcji z innymi zwiększa różnorodność otrzymywanych produktów.
Przykładem połączenia reakcji Ugiego z inną reakcją jest synteza izochinoliny, w której zastosowano reakcję Hecka[20].
Przemysł farmaceutyczny
Produkty farmaceutyczne otrzymywane w reakcji Ugiego to m.in. indynawir[21], lidokaina oraz bupiwakaina.
Przypisy
- ↑ I.I. Ugi I.I. i inni, Versuche mit Isonitrilen, „Angew. Chem.”, 71 (11), 1959, s. 386, DOI: 10.1002/ange.19590711110 (ang.).
- ↑ II. Ugi II., C.C. Steinbrückner C.C., Über ein neues Kondensations-Prinzip, „Angew. Chem.”, 72 (7–8), 1960, s. 267–268, DOI: 10.1002/ange.19600720709 (ang.).
- ↑ I.I. Ugi I.I., The α-Addition of Immonium Ions and Anions to Isonitriles Accompanied by Secondary Reactions, „Angewandte Chemie International Edition in English”, 1 (1), 1962, s. 8–21, DOI: 10.1002/anie.196200081 (ang.).
- ↑ M.C.M.C. Pirrung M.C.M.C., K.D.K.D. Sarma K.D.K.D., Multicomponent Reactions Are Accelerated in Water, „Journal of the American Chemical Society”, 126 (2), 2004, s. 444–445, DOI: 10.1021/ja038583a, PMID: 14719923 (ang.).
- ↑ Ugi i inni, Comprehensive Organic Synthesis, [w:] The Passerini and Ugi Reactions, Oxford: Pergamon, 1991, s. 1083–1109, ISBN 0-08-040593-2 (ang.).
- ↑ I.I. Ugi I.I., B.B. Werner B.B., A.A. Dömling A.A., The Chemistry of Isocyanides, their MultiComponent Reactions and their Libraries, „Molecules”, 8, 2003, s. 53–66, DOI: 10.3390/80100053 (ang.).
- ↑ L.L. Banfi L.L., R.R. Riva R.R., The Passerini Reaction, [w:] Larry E.L.E. Overman (red.), Organic reactions, New York: Wiley, 2005, ISBN 0-471-68260-8, OCLC 57355048 .
- ↑ TempestT. P.A. TempestT., Recent advances in heterocycle generation using the efficient Ugi multiple-component condensation reaction, „Current Opinion in Drug Discovery & Development”, 8 (6), 2005, s. 776–788, DOI: 10.1002/chin.200615243język, =, en, PMID: 16312152 .
- ↑ I.I. Ugi I.I., S.S. Heck S.S., The multicomponent reactions and their libraries for natural and preparative chemistry, „Combinatorial Chemistry & High Throughput Screening”, 4 (1), 2001, s. 1–34, DOI: 10.2174/1386207013331291, PMID: 11281825 (ang.).
- ↑ HuguesH. Bienaymé HuguesH. i inni, Maximizing Synthetic Efficiency: Multi-Component Transformations Lead the Way, „Chemistry – A European Journal”, 6 (18), 2000, s. 3321–3329, DOI: 10.1002/1521-3765(20000915)6:183.0.CO;2-A (ang.).
- ↑ DömlingD. A. DömlingD., UgiU. I. UgiU., Multicomponent Reactions with Isocyanides, „Angewandte Chemie International Edition in English”, 39 (18), 2000, s. 3168–3210, DOI: 10.1002/1521-3773(20000915)39:18<3168::AID-ANIE3168>3.0.CO;2-U (ang.).
- ↑ Scott E.S.E. Denmark Scott E.S.E., YuY. Fan YuY., Catalytic, Enantioselective α-Additions of Isocyanides: Lewis Base Catalyzed Passerini-Type Reactions, „Journal of Organic Chemistry”, 70 (24), 2005, s. 9667–9676, DOI: 10.1021/jo050549m, PMID: 16292793 (ang.).
- ↑ AlexeiA. Ilyin AlexeiA. i inni, Complexity-Enhancing Acid-Promoted Rearrangement of Tricyclic Products of Tandem Ugi 4CC/Intramolecular Diels-Alder Reaction, „Journal of Organic Chemistry”, 71 (25), 2006, s. 9544–9547, DOI: 10.1021/jo061825f (ang.).
- ↑ Laurent ElL.E. Kaim Laurent ElL.E. i inni, Direct Access to Heterocyclic Scaffolds by New Multicomponent Ugi-Smiles Couplings, „Organic Letters”, 8 (18), 2006, s. 4019–4021, DOI: 10.1021/ol061605o (ang.).
- ↑ FlorenceF. Bonnaterre FlorenceF., MichèleM. Bois-Choussy MichèleM., JiepingJ. Zhu JiepingJ., Rapid Access to Oxindoles by the Combined Use of an Ugi Four-Component Reaction and a Microwave-Assisted Intramolecular Buchwald-Hartwig Amidation Reaction, „Organic Letters”, 8 (19), 2006, s. 4351–4354, DOI: 10.1021/ol061755z (ang.).
- ↑ ZhiboZ. Ma ZhiboZ. i inni, Synthesis of Functionalized Quinolines via Ugi and Pd-Catalyzed Intramolecular Arylation Reactions, „J. Comb. Chem”, 8 (5), 2006, s. 696–704, DOI: 10.1021/cc060066b (ang.).
- ↑ S.S. Gedey S.S., J.J. Van der Eycken J.J., F.F. Fülöp F.F., Liquid-Phase Combinatorial Synthesis of Alicyclic β-Lactams via Ugi Four-Component Reaction, „Organic Letters”, 4 (11), 2002, s. 1967–1969, DOI: 10.1021/ol025986r (ang.).
- ↑ J.J. Zhang J.J. i inni, Unique Structures Generated by Ugi 3CC Reactions Using Bifunctional Starting Materials Containing Aldehyde and Carboxylic Acid, „Journal of Organic Chemistry”, 64 (3), 1999, s. 1074–1076, DOI: 10.1021/jo982192a, PMID: 11674195 (ang.).
- ↑ Short K.S.K. M. Short K.S.K., Mjalli A.M.M.A.M. M. Mjalli A.M.M.A.M., A solid-phase combinatorial method for the synthesis of novel 5- and 6-membered ring lactams, „Tetrahedron Letters”, 38 (18), 1997, s. 359–362, DOI: 10.1021/ol048791n, PMID: 15330611 (ang.).
- ↑ Z.Z. Xiang Z.Z. i inni, Novel Pd-II-mediated cascade carboxylative annulation to construct benzo[b]furan-3-carboxylic acids, „Organic Letters”, 6 (18), 2004, s. 3155–3158, DOI: 10.1021/ol048791n, PMID: 15330611 (ang.).
- ↑ K.K. Rossen K.K. i inni, An efficient asymmetric hydrogenation approach to the synthesis of the Crixivan piperazine intermediate, „Tetrahedron Letters”, 39 (38), 1998, s. 6823–6826, DOI: 10.1016/S0040-4039(98)01484-1 (ang.).











