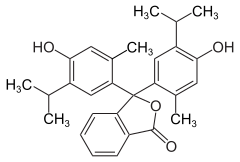
Tymoloftaleina
| |||||||||||||
 | |||||||||||||
| |||||||||||||
| Ogólne informacje | |||||||||||||
| Wzór sumaryczny | C28H30O4 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 430,54 g/mol | ||||||||||||
| Wygląd | biały lub żółtawobiały proszek[1] | ||||||||||||
| Identyfikacja | |||||||||||||
| Numer CAS | 125-20-2 | ||||||||||||
| PubChem | 31316 | ||||||||||||
| |||||||||||||
| |||||||||||||
| |||||||||||||
| Podobne związki | |||||||||||||
| Podobne związki | fenoloftaleina | ||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||
| |||||||||||||
| Tymoloftaleina[2] | ||
|---|---|---|
| pH < 9,3 | ⇄ | pH > 10,5 |
Tymoloftaleina – organiczny związek chemiczny stosowany głównie jako wskaźnik pH. Przy pH ok. 9,3-10,5 jest bezbarwny, zaś powyżej tej wartości staje się niebieski. Barwnik ten jest powszechnie stosowany w alkacymetrii.
Ze względu na to, że w środowisku obojętnym jest bezbarwny, można go stosować też jako atrament sympatyczny. Tymoloftaleina dobrze rozpuszcza się w etanolu, tworząc bezbarwny roztwór. Po dodaniu do tego roztworu odrobiny wodorotlenku potasu zmienia ona barwę na ciemnobłękitną. Po użyciu tego roztworu jako atramentu, napis „znika” w kontakcie z powietrzem, na skutek reakcji wodorotlenku potasu z dwutlenkiem węgla. Ponowne „wywołanie” napisu uzyskuje się przez zanurzenie papieru zawierającego ten napis w dowolnej cieczy, której pH jest większe niż 10,5.[3]
Synteza
Tymoloftaleinę można otrzymać z tymolu i bezwodnika ftalowego w reakcji Friedla-Craftsa[4]:

Przypisy
- ↑ a b Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4 .
- ↑ Acid-Base Indicators. www.csudh.edu. [dostęp 2016-01-19].
- ↑ Krzysztof Orliński: Tymoloftaleina. Młody Technik. [dostęp 2014-08-14]. [zarchiwizowane z tego adresu (2015-03-19)]. (pol.).
- ↑ McCullagh, James V., Daggett, Kelly A. Synthesis of Triarylmethane and Xanthene Dyes Using Electrophilic Aromatic Substitution Reactions. „Journal of Chemical Education”. 84 (11), s. 1799–1802, 2007. DOI: 10.1021/ed084p1799.