| Хлорид тантала(V) |
|---|
 |
| Общие |
Систематическое
наименование | хлорид тантала(V) |
| Традиционные названия | хлористый тантал |
| Хим. формула | TaCl5 |
| Физические свойства |
| Состояние | бесцветные кристаллы |
| Молярная масса | 358,31 г/моль |
| Плотность | 3,68 г/см³ |
| Энергия ионизации | 11,08 эВ[1] |
| Термические свойства |
| Температура |
| • плавления | 216,2; 216,5; 220 °C |
| • кипения | 236; 239; 242 °C |
| Энтальпия |
| • образования | -857,9 кДж/моль |
| Классификация |
| Рег. номер CAS | 7721-01-9 |
| PubChem | 24394 |
| Рег. номер EINECS | 231-755-6 |
| SMILES | |
| InChI | InChI=1S/5ClH.Ta/h5*1H;/q;;;;;+5/p-5 OEIMLTQPLAGXMX-UHFFFAOYSA-I |
| RTECS | WW5600000 |
| ChemSpider | 22805 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
 Медиафайлы на Викискладе Медиафайлы на Викискладе |
Хлорид тантала(V) — неорганическое соединение, соль металла тантала и соляной кислоты с формулой TaCl5, бесцветные кристаллы, реагирует с водой.
Получение




Физические свойства
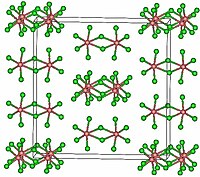
Хлорид тантала(V) образует бесцветные кристаллы моноклинной сингонии, пространственная группа C 2/m, параметры ячейки a = 1,8276 нм, b = 1,7766 нм, c = 0,5850 нм, β = 90,62°, Z = 6. Кристалл состоит из димеров Ta2Cl10. Газовая фаза состоит из мономеров.
Растворяется в этаноле, ацетоне, сероуглероде.
Химические свойства



- Восстанавливается металлами:



- С хлоридами щелочных металлов в концентрированной соляной кислоте образует гексахлоротанталаты:
![{\displaystyle {\mathsf {TaCl_{5}+KCl\ {\xrightarrow {}}\ K[TaCl_{6}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1075738a84ace4dfbe3bfb0bbb6afbbd42d9bf96)
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
 Соединения тантала |
|---|
- Антимонид тантала (Ta5Sb4)
- Бромид тантала(II) (TaBr2)
- Бромид тантала(III) (TaBr3)
- Бромид тантала(V) (TaBr5)
- Гексафторотанталовая кислота (H[TaF6])
- Гептафторотанталат(V) калия (K2[TaF7])
- Диборид тантала (TaB2)
- Иодид тантала(IV) (TaI4)
- Иодид тантала(V) (TaI5)
- Карбид тантала (TaC)
- Карбид тантала-гафния (Ta4HfC5)
- Нитрид тантала (TaN)
- Нитрид тантала(V) (Ta3N5)
- Оксигексафторотанталат калия (K3[TaOF6])
- Оксид тантала(I) (Ta2O)
- Оксид тантала(II) (TaO)
- Оксид тантала(III) (Ta2O3)
- Оксид тантала(IV) (TaO2)
- Оксид тантала(V) (Ta2O5)
- Окситрибромид тантала(V) (TaOBr3)
- Окситрихлорид тантала(V) (TaOCl3)
- Сульфид тантала(IV) (TaS2)
- Фторид тантала(III) (TaF3)
- Фторид тантала(V) (TaF5)
- Хлорид тантала(II) (TaCl2)
- Хлорид тантала(III) (TaCl3)
- Хлорид тантала(IV) (TaCl4)
- Хлорид тантала(V) (TaCl5)
|
Примечания
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5

 Медиафайлы на Викискладе
Медиафайлы на Викискладе









![{\displaystyle {\mathsf {TaCl_{5}+KCl\ {\xrightarrow {}}\ K[TaCl_{6}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1075738a84ace4dfbe3bfb0bbb6afbbd42d9bf96)






