Хлорид германия(II)
| Хлорид германия(II) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | Хлорид германия(II) |
| Традиционные названия | хлористый германий |
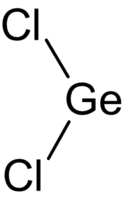
| Хим. формула | GeCl2 |
| Физические свойства | |
| Состояние | белое или жёлтое твёрдое вещество |
| Молярная масса | 143,52 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 74,6 °C |
| • кипения | 450 °C |
| Классификация | |
| Рег. номер CAS | 10060-11-4 |
| PubChem | 6327122 |
| Рег. номер EINECS | 233-192-1 |
| SMILES | Cl[Ge]Cl |
| InChI | InChI=1S/Cl2Ge/c1-3-2 QHGIKMVOLGCZIP-UHFFFAOYSA-N |
| ChemSpider | 4885679 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорид германия(II) — бинарное неорганическое соединение металла германия и хлора с формулой GeCl2, белое или жёлтое твёрдое вещество.
Получение
- Пропускание паров четырёххлористого германия над металлическим германием:
- Действием концентрированной соляной кислоты на соединения двухвалентного германия:
Физические свойства
Хлорид германия(II) образует бесцветные (белые) кристаллы, устойчивый на холоде или в растворах в диоксане, состоит из мономеров GeCl2. При нагревании переходит в жёлтый (оранжевый) полимер (GeCl2)n.
Химические свойства
- При нагревании диспропорционирует:
- Гидролизуется водой:
- Реагирует с газообразным хлористым водородом:
- Реагирует с щелочами:
- Окисляется кислородом и концентрированной азотной кислотой:
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
Классы соединений германия
Соединения германия




![{\displaystyle {\mathsf {GeCl_{2}+2HCl\ {\xrightarrow {40^{o}C}}\ H[GeCl_{3}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b90ed10d90c3c08e9838225dd305f5dd90ce5bbf)












