| ANXA2 |
|---|
 |
| Наявні структури |
|---|
| PDB | Пошук ортологів: PDBe RCSB |
|---|
| Список кодів PDB | | 1W7B, 1XJL, 2HYU, 2HYV, 2HYW, 4DRW, 4FTG, 4HRH | | |
| Ідентифікатори |
|---|
| Символи | ANXA2, ANX2, ANX2L4, CAL1H, HEL-S-270, LIP2, LPC2, LPC2D, P36, PAP-IV, annexin A2 |
|---|
| Зовнішні ІД | OMIM: 151740 MGI: 88246 HomoloGene: 20857 GeneCards: ANXA2 |
|---|
| Онтологія гена |
|---|
| Молекулярна функція | • phospholipase inhibitor activity
• calcium ion binding
• S100 protein binding
• phospholipase A2 inhibitor activity
• calcium-dependent protein binding
• protease binding
• cytoskeletal protein binding
• GO:0001948, GO:0016582 protein binding
• calcium-dependent phospholipid binding
• phosphatidylinositol-4,5-bisphosphate binding
• cadherin binding involved in cell-cell adhesion
• RNA binding
• identical protein binding
• bone sialoprotein binding
• molecular function regulator
• phosphatidylserine binding
• calcium channel activity
• virion binding
• voltage-gated calcium channel activity involved in regulation of cytosolic calcium levels
|
|---|
| Клітинна компонента | • везикула
• гіалоплазма
• ендосома
• мембрана
• late endosome membrane
• Меланосома
• ruffle
• клітинна мембрана
• lipid droplet
• myelin sheath adaxonal region
• Schmidt-Lanterman incisure
• PCSK9-AnxA2 complex
• macropinosome
• базальна мембрана
• cell surface
• lysosomal membrane
• basolateral plasma membrane
• cell cortex
• midbody
• early endosome
• perinuclear region of cytoplasm
• Сарколема
• extrinsic component of plasma membrane
• екзосома
• клітинне ядро
• міжклітинний простір
• azurophil granule lumen
• цитоплазма
• membrane raft
• GO:0005578 Позаклітинна матриця
• extracellular region
• GO:0009327 protein-containing complex
• collagen-containing extracellular matrix
|
|---|
| Біологічний процес | • negative regulation of low-density lipoprotein particle receptor catabolic process
• positive regulation of protein phosphorylation
• protein heterotetramerization
• фібриноліз
• body fluid secretion
• collagen fibril organization
• positive regulation of fibroblast proliferation
• response to thyroid hormone
• positive regulation of binding
• positive regulation of vesicle fusion
• membrane raft assembly
• Ангіогенез
• vesicle budding from membrane
• osteoclast development
• cell-cell adhesion
• GO:0048553 negative regulation of catalytic activity
• positive regulation of receptor recycling
• neutrophil degranulation
• positive regulation of low-density lipoprotein particle clearance
• positive regulation of low-density lipoprotein particle receptor binding
• positive regulation of low-density lipoprotein receptor activity
• positive regulation of receptor-mediated endocytosis involved in cholesterol transport
• negative regulation of formation of structure involved in a symbiotic process
• positive regulation of vacuole organization
• interleukin-12-mediated signaling pathway
• protein localization to plasma membrane
• growth plate cartilage development
• regulation of plasminogen activation
• biomineral tissue development
• positive regulation of chondrocyte differentiation
• positive regulation by host of viral process
• regulation of cytosolic calcium ion concentration
• positive regulation of calcium ion transport
• endocardial cell differentiation
• calcium ion transmembrane transport
• positive regulation of viral life cycle
|
|---|
| Джерела:Amigo / QuickGO | |
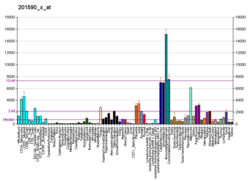
| Шаблон експресії |
|---|


 |
| Більше даних |
| Ортологи |
|---|
| Види | Людина | Миша |
|---|
| Entrez | | |
|---|
| Ensembl | | |
|---|
| UniProt | | |
|---|
| RefSeq (мРНК) | | NM_001002857
NM_001002858
NM_001136015
NM_004039 |
| |
|---|
| RefSeq (білок) | | NP_001002857
NP_001002858
NP_001129487
NP_004030 |
| |
|---|
| Локус (UCSC) | Хр. 15: 60.35 – 60.4 Mb | Хр. 9: 69.36 – 69.4 Mb |
|---|
| PubMed search | [1] | [2] |
|---|
| Вікідані |
| Див./Ред. для людей | Див./Ред. для мишей |
|
ANXA2 (англ. Annexin A2) – білок, який кодується однойменним геном, розташованим у людей на короткому плечі 15-ї хромосоми.[3] Довжина поліпептидного ланцюга білка становить 339 амінокислот, а молекулярна маса — 38 604[4].
Послідовність амінокислот
| 10 | | 20 | | 30 | | 40 | | 50 |
|---|
| MSTVHEILCK | | LSLEGDHSTP | | PSAYGSVKAY | | TNFDAERDAL | | NIETAIKTKG |
| VDEVTIVNIL | | TNRSNAQRQD | | IAFAYQRRTK | | KELASALKSA | | LSGHLETVIL |
| GLLKTPAQYD | | ASELKASMKG | | LGTDEDSLIE | | IICSRTNQEL | | QEINRVYKEM |
| YKTDLEKDII | | SDTSGDFRKL | | MVALAKGRRA | | EDGSVIDYEL | | IDQDARDLYD |
| AGVKRKGTDV | | PKWISIMTER | | SVPHLQKVFD | | RYKSYSPYDM | | LESIRKEVKG |
| DLENAFLNLV | | QCIQNKPLYF | | ADRLYDSMKG | | KGTRDKVLIR | | IMVSRSEVDM |
| LKIRSEFKRK | | YGKSLYYYIQ | | QDTKGDYQKA | | LLYLCGGDD |
Кодований геном білок за функцією належить до фосфопротеїнів. Задіяний у таких біологічних процесах, як ацетилювання, альтернативний сплайсинг. Білок має сайт для зв'язування з іоном кальцію, РНК, іонами кальцію та фосфоліпідами. Локалізований у позаклітинному матриксі, базальній мембрані. Також секретований назовні.
Література
- Spano F., Raugei G., Palla E., Colella C., Melli M. (1990). Characterization of the human lipocortin-2-encoding multigene family: its structure suggests the existence of a short amino acid unit undergoing duplication. Gene. 95: 243—251. PMID 2174397 DOI:10.1016/0378-1119(90)90367-Z
- The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC). Genome Res. 14: 2121—2127. 2004. PMID 15489334 DOI:10.1101/gr.2596504
- Hyatt S.L., Liao L., Chapline C., Jaken S. (1994). Identification and characterization of alpha-protein kinase C binding proteins in normal and transformed REF52 cells. Biochemistry. 33: 1223—1228. PMID 8110754 DOI:10.1021/bi00171a023
- Wright J.F., Kurosky A., Wasi S. (1994). An endothelial cell-surface form of annexin II binds human cytomegalovirus. Biochem. Biophys. Res. Commun. 198: 983—989. PMID 8117306 DOI:10.1006/bbrc.1994.1140
- Gould K.L., Woodgett J.R., Isacke C.M., Hunter T. (1986). The protein-tyrosine kinase substrate p36 is also a substrate for protein kinase C in vitro and in vivo. Mol. Cell. Biol. 6: 2738—2744. PMID 2946940 DOI:10.1128/MCB.6.7.2738
- Kirshner J., Schumann D., Shively J.E. (2003). CEACAM1, a cell-cell adhesion molecule, directly associates with annexin II in a three-dimensional model of mammary morphogenesis. J. Biol. Chem. 278: 50338—50345. PMID 14522961 DOI:10.1074/jbc.M309115200
Примітки
- ↑ Human PubMed Reference:.
- ↑ Mouse PubMed Reference:.
- ↑ HUGO Gene Nomenclature Commitee, HGNC:537 (англ.) . Архів оригіналу за 14 жовтня 2017. Процитовано 11 вересня 2017.
- ↑ UniProt, P07355 (англ.) . Архів оригіналу за 8 серпня 2017. Процитовано 11 вересня 2017.
Див. також
 | Це незавершена стаття про білки.
Ви можете допомогти проєкту, виправивши або дописавши її. |
 Портал «Біологія» Портал «Біологія»  Портал «Хімія» Портал «Хімія»
|
| На цю статтю не посилаються інші статті Вікіпедії. Будь ласка розставте посилання відповідно до прийнятих рекомендацій. |
















